AIMAFIX-D 500 IU 1 flakon
Bölümü
Kullanılır
Kullanılır
Etkileri
Nelerdir
AIMAFIX 500 IU/ 10 mL IV infüzyon için liyofilize toz içeren flakon Steril, apirojen
Damar içine (intravenöz) uygulanır.
Etken Madde
500 IU İnsan plazma kaynaklı yüksek saflıkta pıhtılaşma Faktör IX Yardımcı madde(ler) :Sodyum klorür, sodyum sitrat, glisin, heparin sodyum (domuz bağırsak mukozası), antitrombin III, enjeksiyonluk su.
Bu ilacı kullanmaya başlamadan önce bu KULLANMA TALİMATINI dikkatlice okuyunuz, çünkü sizin için önemli bilgiler içermektedir.
Bu kullanma talimatını saklayınız. Daha sonra tekrar okumaya ihtiyaç duyabilirsiniz.
• Eğer ilave sorularınız olursa, lütfen doktorunuza veya eczacınıza danışınız.
• Bu ilaç kişisel olarak sizin için reçete edilmiştir, başkalarına vermeyiniz.
• Bu ilacın kullanımı sırasında, doktora veya hastaneye gittiğinizde doktorunuza bu ilacı kullandığınızı söyleyiniz.
• Bu talimatta yazılanlara aynen uyunuz. İlaç hakkında size önerilen dozun dışında yüksek veya düşük doz kullanmayınız.
Bu Kullanma Talimatında:
1. AIMAFIX-D nedir ve ne için kullanılır?
2. AIMAFIX-D’i kullanmadan önce dikkat edilmesi gerekenler
3. AIMAFIX-D nasıl kullanılır?
4. Olası yan etkiler nelerdir?
5. AIMAFIX-D’in saklanması
Başlıkları yer almaktadır.
2.AIMAFIX-D kullanmadan önce dikkat edilmesi gerekenler
AIMAFIX-D’i aşağıdaki durumlarda KULLANMAYINIZ
AIMAFIX-D’i aşağıdaki durumlarda DİKKATLİ KULLANINIZ
Eğer;
• Herhangi bir damar içi (intravenöz) protein ürününe karşı alerjik türde aşırı duyarlılığınız varsa,
• Daha önce alerjik reaksiyon geçirdiyşeniz.
AIMAFIX, faktör IX haricinde eser miktarda insan proteinleri içerir.
Eğer bu ilacın uygulanması sırasında aşağıda listelenen semptomlardan herhangi birini fark ederseniz, ilacın kullanımını derhal kesiniz ve doktorunuzla iletişime geçiniz. Bu
semptımlar bir alerjik reaksiyonun erken belirtileri olabilir.
Aşağıdaki semptomlar meydana gelebilir:
• Kurdeşen,
• Tüm vücutta döküntü ( generalize ürtiker),
• Göğüste sıkışma hissi,
• Hırıltılı solunum,
• Hipotansiyon (kan basıncında düşüklük).
Şok durumunda, doktorunuz şok için standart medikal tedaviyi uygulayacaktır.
Eğer heparine bağlı olarak geçirilmiş bir alerjik reaksiyon hikayeniz varsa, heparin içeren ürünlerin kullanımından kaçınmalısınız.
İnsan plazma koagülasyon Faktör IX ürünleri ile tekrarlanan tedavilerden sonra, nötralize edici antikorlar (inhibitörler) gelişmesi ihtimaline karşı hastaların takibi yapılmalıdır.
Literatürde, faktör IX’u nötralize eden antikorların (inhibitörler) oluşumu ile alerjik reaksiyonlar arasında bir ilişki olduğunu gösteren raporlar yer almaktadır. Bu nedenle, aleıjik reaksiyon yaşayan hastalar bir inhibitör bulundurmaları açısından değerlendirilmelidir. Faktör IX inhibitörleri olan hastaların, daha sonra faktör IX’a karşı oluşabilecek anafılaksiler (şiddetli ve hızlı aleıjik reaksiyon) açısından artmış bir risk altında olabileceği göz önünde bulundurulmalıdır.
Faktör IX ürünlerine karşı gelişebilecek alerjik reaksiyon riski nedeniyle, faktör IX’un ilk uygulaması, tedaviyi uygulayan hekimin değerlendirmesine göre, alerjik reaksiyonlara karşı uygun bir tıbbi bakımın sunulabileceği bir yerde, tıbbi gözetim altında gerçekleştirilmelidir.
Tromboembolizm
Faktör IX konsantrelerinin kullanımı, geçmişte tromboembolik komplikasyonların (kan pıhtılarının anormal üretimine bağlı komplikasyonlar) gelişimi ile ilişkili bulunmuştur. Ddüşük saflıktaki preparatlarda bu risk daha yüksek olmuştur. Bu nedenle, Faktör IX içeren ürünlerin kullanımı, yaygın damar içi pıhtılaşmak (edinilmiş trombohemorajik sendrom) hastalar ve fıbrinoliz ( fibrin pıhtılarının kanamaya sebep olabilecek şekilde anormal çözünmesi) belirtileri olan hastalarda potansiyel olarak riskli olabilir. Potansiyel trombotik komplikasyon riski sebebiyle, karaciğer hastalığı olan hastalara, ameliyat sonrası hastalara ya da trombotik fenomen ya da yaygın damar içi pıhtılaşması riski olan hastalara uygulandığında, trombotik ve tüketim (konsumptif) koagülapatisinin erken belirtileri için klinik takibi uygun biyolojik testlerle yapılmalıdır. Bu durumların her birinde, AIMAFIX ile tedavinin yararı bu komplikasyonların riskine karşı değerlendirilmelidir.
Pedivatrik popülasvon
Mevcut veriler AIMAFIX’in 6 yaşından küçük çocuklarda kullanımının önerilmesi için yeterli değildir. Bu bölümde listelenen kullanım oyanları ve önlemler hem yetişkin hem de pediyatrik popülasyon için geçerlidir.
Bu uyanlar geçmişteki herhangi bir dönemde dahi olsa sizin için geçerliyse lütfen doktorunuza danışınız.
AIMAFIX-D’in yiyecek ve içecek ile kullanılması
AEMAFIX uygulanmaları aç veya tok karnına yapılabilir.
Hamilelik
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
AIMAFIX enjeksiyonu hamilelik döneminde kesin gereksinim olduğu takdirde kullanılabilir.
Tedaviniz sırasında hamile olduğunuzu fark ederseniz hemen doktorunuza veya eczacınıza danışınız.
Emzirme
İlacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
AIMAFIX, emzirme döneminde kesin gereksinim olduğu takdirde kullanılabilir.
Araç ve makina kullanımı
AIM AFIX’in araç ve makine kullanımına hiçbir etkisi gözlenmemiştir.
AIMAFIX-D’in içeriğinde bulunan bazı yardımcı maddeler hakkında önemli bilgiler
AIMAFIX 1,8 mmol (41 mg) sodyum içerir. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
AIMAFIX, 100 IU’ya kadar heparin sodyum içermektedir. Alerjik reaksiyonlara ve kanın pıhtılaşma sistemini etkileyebilecek olan kan hücre sayısında düşmelere neden olabilir. Geçmişinde heparinle indüklenmiş alerjik reaksiyonu olan hastaların heparin ihtiva eden ilaçlan kullanmaktan kaçınmalan gerekir.
Diğer ilaçlar ile birlikte kullanımı
İnsan plazma koagülasyon Faktör IX konsantratının diğer ilaçlarla herhangi bir etkileşimi bugüne kadar bilinmemektedir. Ancak AIMAFIX diğer ilaçlarla kanştınlmamalıdır.
5.AIMAFIX-D’in saklanması
Ambalajdaki son kullanma tarihinden sonra AIMAFIX-D’i kullanmayınız.
Eğer ürün ve/veya ambalajında bozukluk fark ederseniz AIMAFIX’i kullanmayınız.
Çevreyi korumak amacıyla kullanmadığınız AIMAFIX’i şehir suyuna veya çöpe atmayınız. Bu konuda eczanıza danışınız.
Son kullanma tarihi geçmiş veya kullanılmayan ilaçlan çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz.
Ruhsat sahibi:
Onko İlaç Sanayi ve Ticaret A.Ş Koşuyolu Cad. No:34 34718 Kadıköy / İstanbul Telefon: +90 (216) 544 90 00 Faks: +90 (216) 545 59 92 e-mail: [email protected]
Üretim yeri:
Kedrion S.p.A., Bolognana, Gallicano, 55027, Lucca, İtalya Tel: +39 0583 1969962
AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
Uyarılar ve önlemler
İnsan plazma pıhtılaşma Faktör IX ürünleri ile tekrarlanan tedaviden sonra, hastalar uygun biyolojik testler kullanılarak Bethesda Unit (BU) olarak belirlenen nötralize edici antikorların (inhibitörleri) gelişimi açısından izlenmelidir.
Dozaj
Yerine koyma tedavisinin dozu ve süresi Faktör IX yetmezliğinin derecesine, kanamanın yerine^ ve boyutuna ve hastanın klinik durumuna bağlıdır.
Uygulanan Faktör IX ünitelerinin sayısı Faktör IX ürünleri için güncel Dünya Sağlık Örgütü standardına göre uluslararası ünite (IU) olarak ifade edilir. Plazmadaki Faktör IX aktivitesi ya bir yüzde (normal insan plazmasına göre) ya da uluslararası üniteler (plazmadaki Faktör IX için uluslararası bir standarta göre) olarak gösterilir.
Bir uluslararası ünite (IU) Faktör IX aktivitesi 1 mL normal insan plazmasında bulunan Faktör IX miktarına eşdeğerdir.
İhtiyaç anında tedavi
Gerekli Faktör IX dozu, 1 IU/kg Faktör IX’un plazma Faktör IX aktivitesini % 0.8 yükselttiği şeklindeki ampirik bulgu esas alınarak hesaplanır.
Gerekli doz aşağıdaki formül kullanılarak hesaplanır.
Gerekli Ünite = Vücut ağırlığı (kg) x İstenen Faktör IX artışı (%) (IU/dl) x (karşılıklı gözlenen geri kazanım)
Uygulanacak miktar ve uygulama sıklığı her vakada daima klinik etkinliğe göre yönlendirilmelidir. Faktör IX ürünleri seyrek olarak günde bir kez uygulamadan daha fazla uygulama gerektirebilir.
Aşağıdaki kanama şekillerinde Faktör IX aktivitesi ilgili dönem süresince belirtilen plazma aktivite seviyelerinin (normalin yüzdesi olarak) altına düşmemelidir. Aşağıdaki tablo kanama episodları ve müdahalelerde doz için kılavuz olarak kullanılabilir.
|
Kanama Derecesi/ Cerrahi Prosedür Türü |
Gerekli plazma Faktör TX seviyesi (%) |
Dozların Sıklığı (saat)/ Tedavinin Süresi (gün) |
|
Hemoraji (Kanama) |
||
|
Erken hemartrozis, |
20-40 |
Her 24 saatte bir tekrarlanır. |
|
Kas kanaması ya da Oral kanama |
Ağrı ile seyreden kanama düzelinceye ya da iyileşme sağlanıncaya kadar en az 1 gün devam edilir. |
|
|
Daha büyük hemartrozis Kas kanaması ya da hematom |
30-60 |
İnfüzyon 3-4 gün ya da daha fazla süreyle, ağrı ve akut yetersizlik düzelinceye kadar her 24 saatte tekrarlanmalıdır. |
|
Hayatı tehdit eden kanamalar |
60-100 |
İnfüzyon, tehlike geçinceye kadar her 8-24 saatte bir tekrarlanmalıdır. |
|
Ameliyat |
||
|
Minör ameliyatlar Diş çekimi dahil |
30-60 |
Her 24 saatte bir, iyileşme gerçekleşinceye kadar en az 1 gün süresince uygulanmalıdır. |
|
Maiör ameliyatlar |
80-100 (pre ve post operatif) |
İnfüzyon, yeterli yara iyileşmesi oluncaya kadar her 8-24 saatte bir tekrarlanmalıdır, daha sonra faktör IX aktivitesini % 30 -% 60 (IU/dL) arasında sürdürmek için en az 7 gün süresince tedaviye devam edilir. |
/
2.AIMAFIX-D nedir ve ne için kullanılır?
• AIMAFIX, kanamayı önleyici/durdurucu etkisi (antihemorajik) sınıfa dahil insan kanından elde edilmiş Faktör IX içeren bir üründür.
• AIMAFIX, toz içeren kauçuk tip I elastomer tıpa ile beraber tip I cam flakon; çözücü içeren tip I elastomer tıpa ile beraber tip I cam flakon; rekonstitüsyon (sulandırma) için pirojenik olmayan, steril, tıbbi cihaz (mix2vial), enjeksiyon için şırınga ve PVC tüp ile beraber kelebek iğnesi içermektedir.
• AIMAFIX, Hemofili B (Konjenital Faktör IX yetmezliği), Edinilmiş Faktör IX yetmezliğinde, kanamanın tedavisi veya korunmasında (profılaksisinde) kullanılır.
3.AIMAFIX-D nasıl kullanılır ?
Bu ilacı tam olarak doktorunuzun söylediği şekilde kullanınız. Emin değilseniz, doktorunuza veya eczacınıza danışınız.
Eğer ilacı kendi kendinize uygulayacaksanız, AIMAFIX’i her zaman tam olarak "Uygun kullanım için talimatlar" bölümünde yer alan talimatlara uygun olarak kullanınız.
İnsan plazma koagülasyon faktör IX, bazı infüzyon ekipmanlarının iç yüzeylerine adsorbe olabileceğinden sonuç olarak tedavi başarısızlığı meydana gelebilir, bu nedenle yalnızca ambalajın içinden çıkan enjeksiyon/infüzyon setlerini kullanınız.
Şüpheleriniz varsa doktorunuza danışınız.
Tedavi, hemofili tedavisi konusunda deneyimli bir doktorun gözetimi altında başlatılmalıdır.
Doktorunuz faktör IX yetmezliğinizin şiddetine, kanamanın yeri ve miktarına ve klinik durumunuza bağlı olarak tedaviniz için uygun dozu ve tedavi süresini belirleyecektir. Uygulanacak miktar ve uygulama sıklığı her vakada daima klinik etkinliğe göre yönlendirilmelidir.
Faktör IX ürünlerinin nadiren günde birden fazla uygulanması gerekir.
Tedavi süresince, uygulanacak doz ve tekrarlanan infüzyonların sıklığına yol göstermesi için, Faktör IX seviyelerinin uygun bir şekilde belirlenmesi önerilir. Özellikle majör ameliyat durumlarında, koagülasyon analizi (plazma Faktör IX aktivitesi) yoluyla yerine koyma tedavisinin titizlikle takibi gereklidir.
Farklı in vivo geri kazanım seviyeleri ve farklı yarılanma zamanı göstermeleri nedeniyle her bir hastanın faktör IX’a karşı cevabı değişebilir.
Bu kullanma talimatının sonunda sağlık personeline yönelik hazırlanmış olan bölümde dozaj
ve tedavi süresine ilişkin daha fazla bilgi yer almaktadır.
Kanama Profılaksisi
Şiddetli Hemofili B hastalarında kanamaya karşı uzun dönem profılaksi (korunma) için, alışılmış dozlar 3-4 günlük aralıklarla vücut ağırlığının kg başına 20-40 IU Faktör IX’dur. Bazı vakalarda, özellikle genç hastalarda, daha kısa doz aralıkları ya da daha yüksek dozlar gerekebilir.
Hastaların izlenmesi
Hastalar Faktör IX inhibitörlerinin gelişimi açısından takip edilmelidir. Eğer beklenen Faktör IX aktivite plazma seviyelerine ulaşılamazsa, ya da kanama uygun bir doz ile kontrol edilemezse, Faktör IX inhibitörü olup olmadığı bir tahlil yapılarak belirlenmelidir. Yüksek seviyelerde inhibitörlü hastalarda Faktör IX tedavisi etkili olmayabilir ve diğer terapötik seçenekler dikkate alınmalıdır. Bu gibi hastaların tedavisi hemofili hastaların tedavisi konusunda uzman kişiler tarafından yapılmalıdır.
Uygulama yolu ve metodu
İntravenöz (damar içi) kullanım içindir.
Damar içine (intravenöz) yavaş olarak enjekte edilir ya da infüzyonla verilir.
Vücut ağırlığına göre günde 100 IU/kg’dan daha fazla doz uygulanması tavsiye edilmez. İnfüzyon hızı her hastaya göre bireysel olarak değerlendirilmelidir.
Uygun kullanım için talimatlar
Tozun çözücü ile rekonstitüe edilmesi (sulandırılması)
1. Toz halde etken madde içeren flakon ve çözücü flakonu oda sıcaklığına getiriniz;
2. Bu sıcaklık, tüm rekonstitüsyon (sulandırma) işlemi süresince ( maksimum 10 dakika) korunmalıdır;
3. Toz etken madde içeren flakon ve çözücü flakonun koruyucu kaplarını çıkarınız;
4. İki flakon tıpasının yüzeyini alkol ile temizleyiniz;
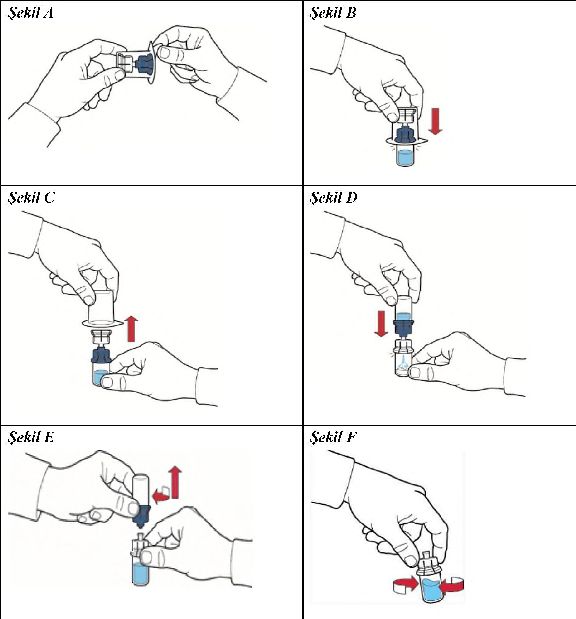
5. Üst başlığı sıyırarak aparatın ambalajını açınız; iç kısma dokunmamaya dikkat ediniz (Şekil A);
6. Aparatı ambalajından çıkarmayınız;
7. Aparat kutusunu baş aşağı çeviriniz ve çözücü flakon tıpasına doğru plastik sivri ucu yerleştiriniz, böylece aparatın mavi kısmı çözücü flakona bağlanmış olur ( Şekil B);
8. Aparat kutusunun kenarını tutunuz ve aparata dokunmadan dışarı çıkarınız ( Şekil C);
9. Toz flakonun güvenli bir yüzeye yerleştirildiğinden emin olunuz, sistemi baş aşağı çeviriniz böylece çözücü flakon aparatın üstünde olur; toz flakon tıpasının üzerindeki şeffaf adaptöre bastırınız, böylece plastik sivri uç toz flakon tıpanın içinden geçer; çözücü, toz flakonun içine otomatik olarak çekilecektir ( Şekil D);
10. Çözücünün transferinden sonra, transfer sisteminde çözücü flakonunun bağlı olduğu mavi kısmı gevşetiniz ve çıkarınız ( Şekil E);
11. Toz etkin madde tamamen çözününceye kadar flakonu yavaşça çalkalayınız. Köpürmeyi önlemek amacıyla, flakonu kuvvetlice çalkalamayınız (Şekil F);
Tozun tam em en çözündüğünden emin olunuz, aksi taktirde ürünün akti vitesinde kayıp olacaktır.
Çözeltinin uygulanması
Uygulamadan önce, rekonstitüe edilmiş (sulandırılmış) ürün partikül olup olmadığı ve renk değişimini saptamak için, görsel olarak incelenmelidir. Çözelti berrak ve hafif opelesan olmalıdır. Bulanık veya tortulu çözeltileri kullanmayınız.
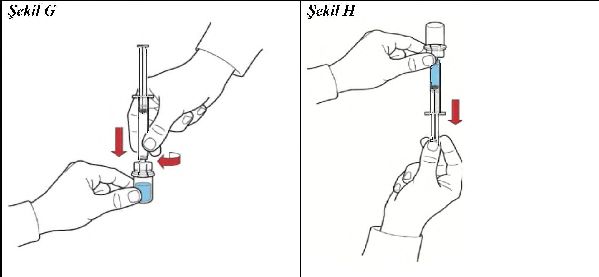
1. Şırıngayı hava ile doldurunuz, pistonu geri çekiniz, aparata tutturunuz ve havayı rekonstitüe edilmiş (sulandırılmış) çözeltiyi içeren toz flakonun içine enjekte ediniz (Şekil G);
2. Pistonu bırakınız, sistemi baş aşağı çeviriniz böylece, rekonstitüe edilmiş (sulandırılmış) çözeltiyi içeren toz flakon aparatın üstünde olacaktır ve piston yavaşça geri çekerek konsantreyi şırınganın içine çekiniz (Şekil H);
3. Şırıngayı saat yönünün tersine çevirerek ayırınız;
4. Şırınganın içindeki çözeltiyi görsel olarak inceleyiniz, partikülsüz, berrak veya hafif opelesan olmalıdır;
5. Kelebek iğnesini şırıngaya takınız ve intravenöz olarak infüzyon veya yavaşça enjeksiyon yoluyla uygulayınız.
Flakonlar bir kere açıldıktan sonra, içerik derhal kullanılmalıdır.
Rekonstitüe edilmiş (sulandırılmış) ve şırınganın içine transfer edilmiş çözelti derhal kullanılmalıdır.
Flakon içeriği tek bir uygulama içindir.
Etikette yer alan son kullanma tarihinden sonra bu ürünü kullanmayınız.
Kullanılmayan ürün veya atık materyal yerel şartlara uygun olarak imha edilmelidir.
Tüm kullanılmayan ürün ve atık maddeler "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri” ne uygun olarak imha edilmelidir.
Değişik yaş grupları
Çocuklarda kullanımı
6 yaşından küçük çocuklarda AEVLAFIK’in güvenlilik ve etkililiğine ilişkin yeterli veri yoktur.
Yaşlılarda kullanımı
Yaşlı popülasyonda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Özel kullanım durumları
Böbrek/ Karaciğer yetmezliği:
Böbrek/karaciğer yetmezliği olan hastalarda doz ayarlaması gerekliliği ile ilgili herhangi bir veri yoktur.
Eğer AIMAFIX’irı etkisinin çok güçlü veya zayıf olduğuna dair bir izleniminiz var ise doktorunuz veya eczacınız ile konuşunuz.
Kullanmanız gerekenden daha fazla AIMAFIX-D kullanırsanız
İnsan plazma koagülasyon faktör IX’un aşırı dozda kullanımına ilişkin semptomlar raporlanmamıştır.
AIM AFIX’in kullanımına ilişkin bir şüpheniz varsa dpktorunuza veya eczacınıza danışınız. AIMAFIX’den kullanmanız gerekenden fazlasını kullanmışsanız bir doktor veya eczacı ile konuşunuz.
AIMAFIX-D'i kullanmayı unuttuysanız
Unutulan dozları dengelemek için çift doz almayınız.
AIMAFIX-D ile tedavi sonlandırıldığında oluşabilecek etkiler
4.Olası yan etkiler nelerdir ?
Tüm ilaçlar gibi AIMAFIX-D’in içeriğinde bulunan maddelere duyarlı olan kişilerde yan etkiler olabilir.
İnsan plazma koagülasyon faktör IX uygulaması ile ilişkili olşduğu bilinen advers reaksiyonlar, AIMAFIX uygulaması ile de meydana gelebilir.
Aşağıdakilerden biri olursa AIMAFIX-D’ü kullanmayı durdurun ve DERHAL doktorunuza bildirin veya size en yakın hastanenin acil bölümüne başvurunuz
• Ciddi alerjik reaksiyonlar (hipersensitivite): deri ve mukozanın hızlıca şişmesi (anjiyoödem). Bu yan etki nadiren görülür ve bazı vakalarda şok dahil akut alerjik reaksiyonlara (anaflaksi) ilerleyebilir.
• Faktör IX inhibitörleri ve alerjik reaksiyon hikayesi olan hemofili B hastalarında immün tolerans indüksiyonunu takiben nefrotik sendrom (kandaki normal protein seviyelerinde düşüş ile sonuçlanan proteinlerin idrarla kaybı ile karakterize bir şiddetli böbrek yetmezliği durumu) rapor edilmiştir.
• Hemofili B hastaları Faktör IX’a karşı nötralize edici antikorlar (inhibitörler) geliştirebilir. Bu inhibitörler oluşursa, bu durum klinik cevap yetersizliği olarak kendini gösterir. Bu gibi vakalarda, özel bir hemofili merkezine danışılmalıdır.
• Faktör IX ürünlerinin uygulamasını takiben, düşük saflıkta preparatlar için daha yüksek olan, potansiyel bir tromboembolik olay (anormal kan pıhtısı üretimi) riski vardır. Düşük saflıkta Faktör IX ürünlerinin kullanımı kalp krizi, yaygın damar içi pıhtılaşması ( kan damarlarının içinde yaygın pıhtılaşma), venöz trombozis (toplar damarlar içinde kan pıhtıları oluşması) ve pulmoner embolizm ( akciğerlerde kan pıhtıları oluşması) örnekleri ile bağlantılıdır. Bu gibi istenmeyen etkiler yüksek saflıkta Faktör IX kullanımı ile nadiren görülür.
Bunların hepsi çok ciddi yan etkilerdir.
Eğer bunlardan biri sizde mevcut ise, acil tıbbi müdahaleye veya hastaneye yatırılmanıza gerek olabilir
Diğer yan etkilerYan etkiler aşağıdaki kategorilerde gösterildiği şekilde sınıflandırılmıştır:
Çok yaygın: 10 hastanın en az birinde görülebilir.
Yaygın: 10 hastanın birinden az, fakat 100 hastanın birinden fazla görülebilir.
Yaygın olmayan: 100 hastanın birinden az, fakat 1.000 hastanın birinden fazla görülebilir. Seyrek: 1.000 hastanın birinden az görülebilir fakat 10.000 hastanın birinden fazla görülebilir. Çok seyrek: 10.000 hastanın birinden az görülebilir.
Bilinmiyor: Eldeki verilerden hareketle tahmin edilemiyor.
Bilinmiyor• İnfüzyon bölgesinde yanma ve batma hissi (infüzyon bölgesinde ağrı)
• Titreme, yüz kızarması, kurdeşen, tüm vücutta döküntü ( generalize ürtiker)
• Baş ağrısı
• Kan basıncında düşüklük (hipotansiyon), huzursuzluk, kalp atımının hızlanması (taşikardi), göğüste sıkışma hissi (göğüs ağrısı), hırıltılı solunum
• Bilinç uyuşukluğunun eşlik ettiği hareketsizlik hali (Letaıji)
• Kol ve bacaklarda veya vücudun diğer bölümlerinde karıncalanma veya hissizlik (parestezi)
• Bulantı, kusma
• Ateş
Bu yan etkiler nadiren gözlemlenmiş olup, bazı vakalarda şok dahil şiddetli anaflaksilere ( hızlı ve şiddetli alerjik reaksiyon) dönüşebilir. Bazı vakalarda, bu reaksiyonlar şiddetli anaflaksiye (hızlı ve şiddetli alerjik reaksiyon) ilerlemiştir ve faktör IX inhibitörlerinin gelişimi ile zamansal olarak yakından ilişkili şekilde meydana gelmiştir.
Pedivatrik popülasvon
Pediyatrik popülasyon için spesifik veri mevcut değildir.
Virüs güvenliği hakkında bilgiler için “2. AIMAFIX’i kullanmadan önce dikkat edilmesi gerekenler” bölümüne bakınız.
Yan etkilerin raporlanması
Kullanma Talimatında yer alan veya almayan herhangi bir yan etki meydana gelmesi durumunda hekiminiz, eczacınız veya hemşireniz ile konuşunuz. Ayrıca karşılaştığınız yan etkileri www.titck.gov.tr sitesinde yer alan “İlaç Yan Etki Bildirimi“ ikonuna tıklayarak ya da 0 800 314 00 08 numaralı yan etki bildirim hattını arayarak Türkiye Farmakovijilans Merkezi (TÜFAM)‘ne bildiriniz. Meydana gelen yan etkileri bildirerek kullanmakta olduğunuz ilacın güvenliliği hakkında daha fazla bilgi edilnilmesine katkı sağlamış olacaksınız.
